
A lo largo de la historia de la ciencia, las células electrolíticas han jugado un papel esencial en la comprensión y aplicaciones de la electricidad y la química. Aunque suena como un concepto complejo, en realidad se trata de una tecnología fascinante y cotidiana a la vez. Quien haya escuchado hablar de dispositivos como la SEN0376, habrá notado que estos sistemas son fundamentales para procesos industriales, investigaciones científicas e incluso para la educación escolar.
Si alguna vez te has preguntado qué es una célula electrolítica activa y cómo funciona exactamente, aquí lo descubrirás con todo detalle. En este artículo vamos a profundizar en el funcionamiento, los principios que rigen su actividad, sus componentes, diferencias con otras celdas y sus aplicaciones, todo ello de forma exhaustiva y sencilla para que cualquier persona, independientemente de su nivel de conocimiento previo, pueda comprenderlo sin dificultad.
¿Qué es una célula electrolítica activa?
Una célula electrolítica activa es un dispositivo capaz de convertir energía eléctrica en energía química mediante un proceso muy concreto: la electrólisis. Su función principal es impulsar reacciones químicas no espontáneas, es decir, aquellas que no ocurrirían por sí solas bajo condiciones normales. Para lograr esto, la célula emplea una fuente de corriente externa que obliga a los electrones a moverse a través del sistema, generando cambios en los compuestos químicos implicados.
Cuando hablamos de una célula activa como la SEN0376, generalmente nos referimos a un modelo comercial pensado para aplicaciones prácticas como la purificación de agua, la obtención de productos químicos o la enseñanza experimental. Sin embargo, el principio de funcionamiento es común a todas ellas y se basa en la interacción entre electrodos y una solución electrolítica con iones libres.
Principios básicos de la electrólisis
La clave detrás de una célula electrolítica activa es el proceso de electrólisis. Se trata de un fenómeno donde una corriente eléctrica provoca la descomposición de sustancias químicas. En otras palabras, se utiliza electricidad para romper enlaces químicos y separar un compuesto en sus elementos o formar nuevas sustancias.
Este proceso requiere, como mínimo, tres componentes esenciales: una fuente de energía eléctrica, dos electrodos (ánodo y cátodo) y una solución electrolítica que actúa como medio conductor. La electricidad obliga a los iones a movilizarse dentro del electrolito, lo que desencadena las reacciones en superficie de los electrodos.
- Fuente de alimentación eléctrica: es el dispositivo que genera la diferencia de potencial necesaria para estimular el flujo de electrones.
- Electrodos: el ánodo (polaridad positiva) y el cátodo (polaridad negativa) son los puntos donde ocurren las reacciones de oxidación y reducción respectivamente.
- Electrolito: una solución con iones libres capaz de conducir la corriente eléctrica.
Al encender la fuente, los electrones se ven obligados a viajar desde el cátodo hacia el ánodo a través del circuito externo, mientras que en el interior de la celda los iones se movilizan para compensar este flujo, permitiendo que ocurran las reacciones químicas en cada electrodo.
Funcionamiento detallado de una célula electrolítica activa
El proceso comienza con la conexión del sistema a una fuente de corriente. Al cerrar el circuito, la fuente genera la diferencia de potencial que dirige el flujo de electrones externos. Dentro de la célula, el ánodo es el electrodo donde se producen las reacciones de oxidación (los átomos o iones pierden electrones), mientras que en el cátodo tienen lugar las reacciones de reducción (los átomos o iones ganan electrones). El movimiento de electrones entre los electrodos produce los cambios químicos deseados en la sustancia electrolítica, ya sea su descomposición, la liberación de gases, la formación de precipitados o la deposición de metales.
Todo este proceso no ocurriría de manera espontánea. Es la energía eléctrica externa la que fuerza a los iones a moverse y transformarse, haciendo posible fenómenos como la electrólisis del agua para obtener hidrógeno y oxígeno, o la obtención de metales puros en la industria.
Componentes de una célula electrolítica activa
Para comprender a fondo el funcionamiento y utilidad de una célula electrolítica, conviene conocer sus partes fundamentales:
- Ánodo: normalmente fabricado con un material resistente a la oxidación, como platino, grafito o metales recubiertos de óxidos metálicos. Es donde los iones se oxidan y ceden electrones al circuito externo.
- Cátodo: puede estar hecho de un metal como cobre o acero inoxidable y es el lugar donde los iones reciben electrones y se reducen.
- Electrolito: una solución o una sustancia fundida que contiene iones libres capaces de transportar carga. Ejemplos típicos son soluciones de sales, ácidos o bases.
- Fuente de alimentación: suministra la energía eléctrica necesaria con la polaridad adecuada.
- Recipiente: generalmente de vidrio, plástico o materiales resistentes a la corrosión, contiene el electrolito y los electrodos.
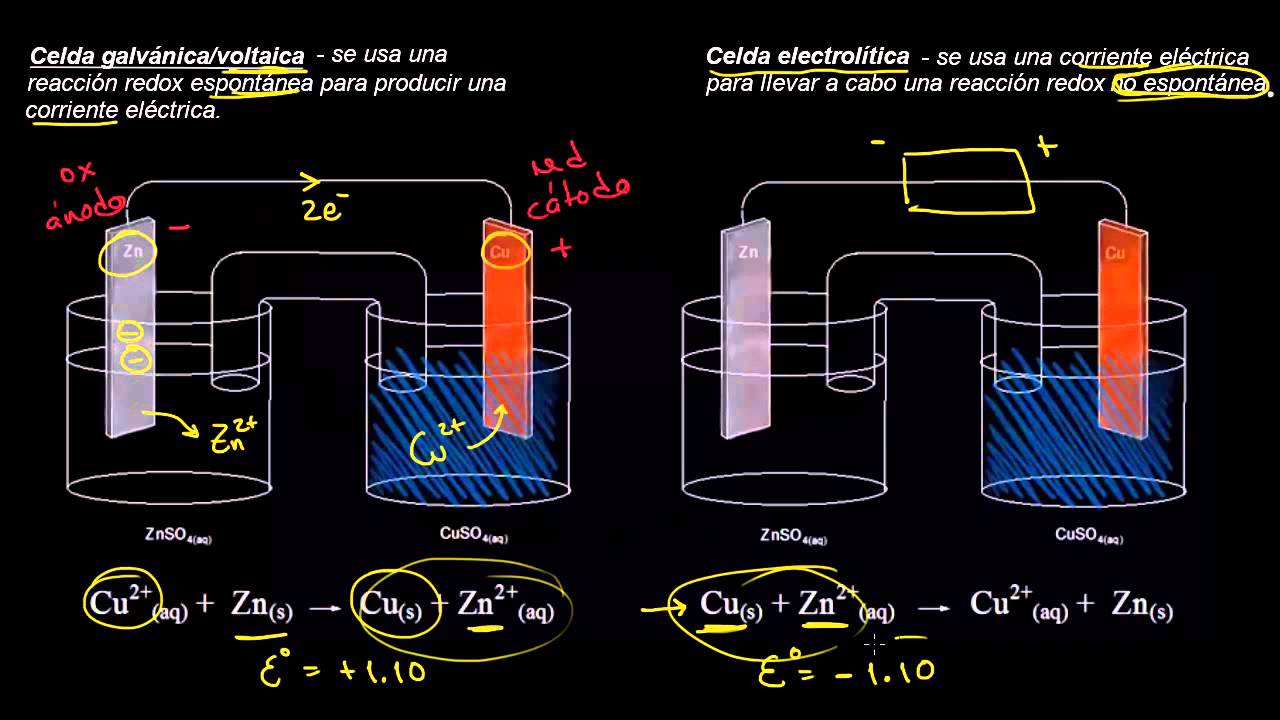
Diferencias entre células electrolíticas y células galvánicas
Frecuentemente se confunden las células electrolíticas con las células galvánicas (o voltaicas), ya que ambas involucran flujos de electrones y reacciones químicas. Sin embargo, su funcionamiento y propósito son totalmente opuestos.
- Célula galvánica: convierte la energía química en energía eléctrica a través de reacciones espontáneas. Es el caso clásico de las pilas y baterías convencionales.
- Célula electrolítica: utiliza energía eléctrica para forzar reacciones químicas no espontáneas. Aquí la dirección del flujo electrónico y la naturaleza de los procesos químicos es la contraria a una pila.
En otros términos, mientras que en una pila galvánica la química genera electricidad, en una electrolítica la electricidad genera química. Este principio es lo que aprovechan dispositivos activos como la SEN0376 para procesos de purificación, síntesis y deposición de materiales.
Aplicaciones de las células electrolíticas activas en la vida real
Las celdas electrolíticas tienen una variedad enorme de aplicaciones tanto en la industria como en el laboratorio o el hogar. Aquí vamos a repasar algunas de las más importantes:
- Obtención de metales puros: por ejemplo, la electrólisis del cobre para obtenerlo en estado puro a partir de minerales o chatarra. Este proceso es esencial en la industria metalúrgica.
- Purificación de agua: dispositivos como la SEN0376 son comunes en sistemas de tratamiento de aguas domésticas o industriales, donde la electrólisis ayuda a eliminar contaminantes mediante la descomposición de compuestos orgánicos e inorgánicos.
- Producción de gases industriales: la electrólisis del agua permite producir hidrógeno y oxígeno de alta pureza, usados en combustibles, medicina y procesos industriales.
- Galvanoplastia y recubrimientos metálicos: mediante el uso de células electrolíticas se pueden depositar capas de metales como oro, plata o níquel sobre otras piezas, mejorando su resistencia, apariencia y funcionalidad.
- Producción de productos químicos: como la obtención de cloro y sosa cáustica por electrólisis de salmuera, fundamentales en la industria química.
- Descomposición de compuestos orgánicos e inorgánicos: se emplea para transformar contaminantes en sustancias menos nocivas o directamente eliminables.
- Aplicaciones educativas: la sencillez de montaje y observación de las celdas electrolíticas las convierte en un recurso ideal para explicar conceptos de química, física y tecnología en centros de enseñanza.
¿Cómo es el proceso dentro de la célula electrolítica?
Vamos a profundizar un poco más en lo que ocurre en el interior de una célula electrolítica como la SEN0376. Supongamos que tenemos una solución salina simple y dos electrodos conectados a una fuente de corriente continua.
Cuando la corriente fluye, se produce una migración sistemática de iones:
- Los iones positivos del electrolito (cationes) se dirigen hacia el cátodo, donde reciben electrones y se reducen.
- Los iones negativos (aniones) migran al ánodo, donde ceden electrones y se oxidan.
Como resultado, los productos de las reacciones pueden ser gases (como hidrógeno u oxígeno), metales depositados o compuestos nuevos en solución.
El proceso no solo requiere la presencia de los iones adecuados, sino también de electrodos apropiados según el tipo de reacción que se desee. Por ejemplo, para la obtención de cloro y sodio metálico se emplean electrodos especiales y se controla cuidadosamente la composición y temperatura del electrolito.
La importancia de los electrodos y el electrolito
En una célula electrolítica activa, la selección de los electrodos y la composición del electrolito determina la eficiencia, productos y durabilidad del proceso. Si deseas conocer más sobre sistemas que gestionan energía reactiva, también te puede interesar cómo gestionar la energía reactiva en sistemas eléctricos.
En dispositivos modernos, como los sistemas de tratamiento de agua tipo SEN0376, a menudo se utilizan ánodos de titanio recubierto de óxidos metálicos y electrolitos no corrosivos para maximizar la vida útil y la seguridad.
Eficiencia y mantenimiento de una célula electrolítica activa
El rendimiento de una célula electrolítica depende de diversos factores: la calidad y el estado de los electrodos, la concentración y temperatura del electrolito, y el correcto funcionamiento de la fuente de energía. Un parámetro importante es la eficiencia farádica, que mide la proporción de carga eléctrica que realmente contribuye a la reacción química deseada.
Cada dispositivo requiere un mantenimiento regular: limpieza de electrodos para evitar la formación de capas pasivantes, reposición del electrolito y comprobación de conexiones eléctricas seguras. En modelos modernos, muchas tareas están automatizadas, pero en entornos experimentales o industriales suelen requerir la supervisión de técnicos especializados.
Ventajas y limitaciones
Las células electrolíticas activas presentan numerosas ventajas:
- Permiten controlar de forma precisa reacciones químicas que de otro modo serían imposibles o peligrosas.
- Versatilidad: pueden emplearse en una amplia gama de procesos industriales, científicos y domésticos.
- Escalabilidad: desde dispositivos de laboratorio hasta grandes plantas industriales.
- Aplicaciones medioambientales: en tratamiento de residuos y descontaminación.
Sin embargo, también tienen algunas limitaciones importantes:
- El consumo de energía puede ser elevado, especialmente en procesos a gran escala.
- La vida útil de los electrodos puede reducirse por corrosión o acumulación de productos inertes.
- No todas las reacciones químicas pueden realizarse de manera eficiente mediante electrólisis.
Innovación y tendencias en células electrolíticas activas
El desarrollo de nuevos materiales para electrodos, el diseño de celulares más compactas y eficientes y la integración de sistemas inteligentes de control están revolucionando el sector. La capacidad de monitorizar parámetros en tiempo real, ajustar automáticamente la intensidad de corriente o detectar anomalías ha mejorado notablemente el rendimiento y la seguridad de estas celdas.
Así, la célula electrolítica activa no solo se mantiene vigente en la industria tradicional, sino que cada vez gana más espacio en campos como la producción de energías limpias (por ejemplo, hidrógeno verde), la medicina (esterilización de instrumentación) y la nanotecnología (fabricación de nanocomponentes). Si quieres profundizar sobre componentes electrónicos relacionados, echa un vistazo a el funcionamiento de las células Peltier.
Adicionalmente, los dispositivos modernos han mejorado la sostenibilidad utilizando materiales reciclables y optimizando los consumos energéticos, lo que permite reducir el impacto ambiental de los procesos industriales asociados a electrólisis.




